지뉴브, 신경신생·항상성 유도 'ALS치료제' 1/2a상 돌입
국내 4개병원서 환자모집 돌입..기존 '리루졸'과 안전성, 유효성 비교
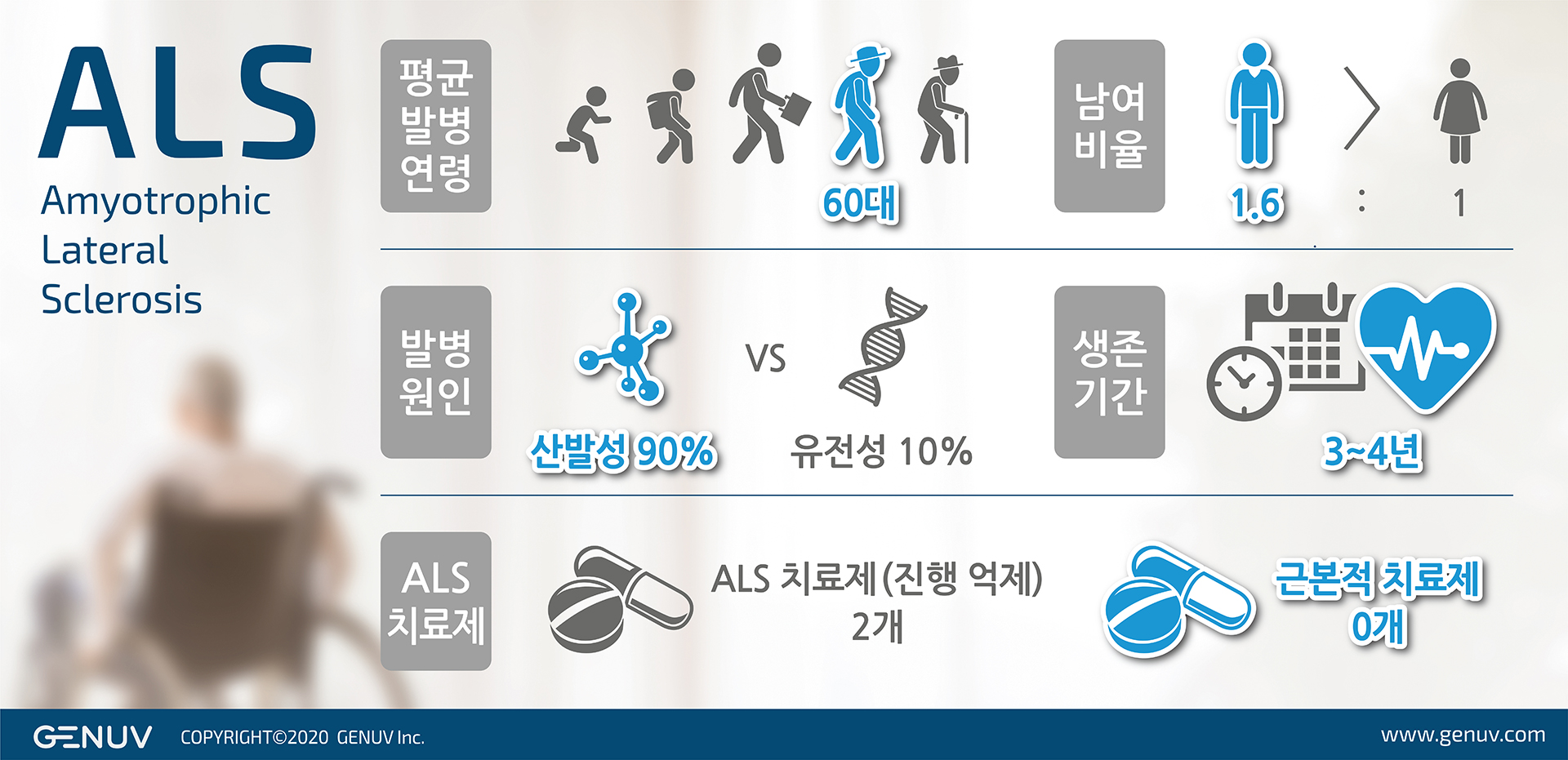
지뉴브(GENUV)가 첫 파이프라인인 근위축성측삭경화증(ALS) 치료제 'SNR1611'의 국내 1/2a상에 돌입한다.
지뉴브는 13일 "ALS치료제 SNR1611이 최근 국내 4개 병원의 임상시험심사위원회(IRB) 승인 절차를 완료하고 환자모집을 시작했다"고 밝혔다.
지뉴브는 신경신생(neurogenesis)과 신경항상성(neural homeostasis)을 유도하는 물질이 ALS를 비롯한 퇴행성신경질환의 치료에 효과적일 것으로 보고 약물재창출 방식으로 SNR1611을 발굴해 개발하고 있다.
지뉴브는 지난해 9월 식품의약품안전처로부터 3개 기관에서 SNR1611 임상시험계획(IND)을 승인 받았다. 이후 임상시험 실시를 위한 절차를 밟는 과정에서 기관 수를 확대해 최종적으로 4개 병원(삼성서울병원, 연세대학교 세브란스병원, 서울아산병원, 고려대학교 안암병원)에서 IRB 승인을 받게 됐다.
이번 임상 1/2a상 시험은 ALS 증상 시작이 스크리닝 방문 이전 2년 이내인 환자 중 임상시험 기준에 부합하는 환자를 대상으로 수행되며, 기존 약인 리루졸(Riluzole)과 비교해 SNR1611의 안전성, 내약성 및 유효성을 평가하는 방식으로 진행된다. 지난 10일 기준으로 삼성서울병원, 고려대학교 안암병원 및 서울아산병원에서 환자 모집이 시작됐고 세브란스병원에서도 이달 중 환자 모집에 들어갈 예정이다.
지뉴브 관계자는 “이번 임상시험을 통해 치료제가 간절한 ALS 환자와 가족들을 위해 실질적인 도움을 줄 수 있는 치료제로서의 가능성이 입증되기를 희망한다”고 말했다.
...
기사 전문 바로가기
|
